Trabajo presentado en XIX Reunión Científico Técnica de la Asociación Argentina de Veterinarios de Laboratorios de Diagnóstico (AAVLD), C.A.B.A., Provincia de Buenos Aires, Argentina. Año 2012.
Fiorentino,M.A1.; Moreira, A.R1.; Malena, R. 1; Mendez, A1.; Paolicchi, F1
1 Laboratorio de Bacteriología – EEA INTA Balcarce.
mafiorentino@balcarce.inta.gov.ar
Introducción
El síndrome respiratorio bovino (SRB) es una de las principales causas de enfermedad y muerte en terneros durante las primeras semanas de vida y en la primera etapa de la recría, originando importantes pérdidas económicas. Tres son las bacterias que están frecuentemente asociadas al SRB: Mannheimia haemolytica (antes Pasteurella haemolytica), Pasteurella multocida, y Histophilus somni (antes Haemophilus somnus). Las vacunas disponibles contra estas bacterias han demostrado disminuir la incidencia de la enfermedad pero nunca han sido absolutamente efectivas. Ante la aparición de terneros con signos clínicos de SRB es indispensable tomar medidas para su control y la administración de antimicrobianos es el tratamiento de elección y la correcta elección de los mismos define el éxito o fracaso del tratamiento.
El objetivo del presente trabajo fue evaluar la sensibilidad in vitro a antibióticos de las cepas de M. haemolytica, P. multocida e H. somni aisladas de pulmones de bovinos con neumonía remitidos al Laboratorio de Bacteriología de la EEA Balcarce desde el años 2001 hasta 2012.
Materiales y métodos
La sensibilidad a diferentes antimicrobianos fue determinada en 27 cepas de P. multocida, 21 de M. haemolytica y 20 de H. somni, mediante el método de Kirby-Bauer utilizando sensidiscos comerciales que contenían los siguientes antimicrobianos: ampicilina 10 µg, enrofloxacina 5 µg, eritromicina 15 µg, estreptomicina 300 µg, gentamicina 10 µg, kanamicina 30 µg, ofloxacina 5 µg, penicilina G 10 U, sulfametoxazoltrimetoprima 25 µg y tetraciclina 30 µg.
Los inóculos se estandarizaron agregando la cepa a probar, cultivada previamente en agar sangre Columbia, en un tubo con PBS hasta alcanzar una turbidez comparativa con el estándar 0,5 de McFarland (5 x 107 a 5 x 109 ufc/mL). Con hisopo estéril se distribuyó la suspensión bacteriana en toda la superficie de una placa de Petri con agar Müeller-Hinton; se colocaron los sensidiscos y se incubó a 37ºC durante 24 h. Según el tamaño de la zona de inhibición, se determinó la resistencia o sensibilidad de cada cepa para cada uno de los antibióticos antes mencionados, siguiendo las recomendaciones de Barry y Thonsberry.
Resultados
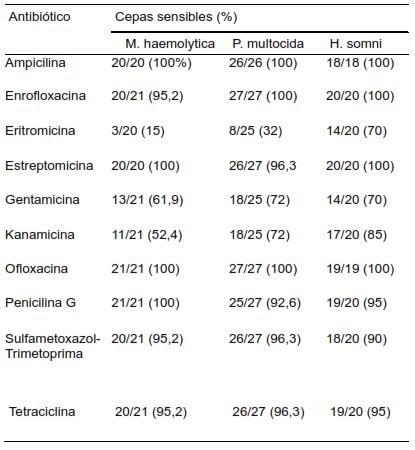
Los resultados obtenidos para cada una de las cepas se presentan en la tabla. El 100% de las cepas de H. somni, M. haemolytica y P. multocida estudiadas fueron sensibles a ampicilina y ofloxacina. El 55%, 90,5% y 77,8% de las cepas de H. somni, M. haemolytica y P. multocida respectivamente, fueron resistentes al menos a uno de los antibióticos estudiados.
El 30% de las cepas de H. somni presentaron resistencia a eritromicina y gentamicina, siendo éstos los niveles más altos de resistencia observados en esta especie bacteriana. En cuanto a las cepas de M. haemolytica estudiadas el 85% fueron resistentes a eritromicina, pero también se observaron niveles importantes de resistencia también para gentamicina (38%) y kanamicina (47,6%). Sin embargo, en las cepas de M. haemolytica se presentaron niveles muy bajos de resistencia a enrofloxacina, sulfametoxazol-trimetoprima y tetraciclina. En las cepas de P. multocida se encontró un gran índice de resistencia a eritromicina (68%) y cercanos al 30% para estreptomicina y gentamicina. El resto de los antibióticos evaluados presentaron niveles de sensibilidad superiores al 90%.
Discusión
En el presente trabajo se evaluó la sensibilidad in vitro de las bacterias asociadas con mayor frecuencia al SRB. En la bibliografía consultada no se encontraron antecedentes de trabajos previos en Argentina, sin embargo varios autores han reportado el aislamiento de cepas de H. somni, P. multocida y M. haemolytica con resistencia a uno o más antibióticos en otros países. Coincidiendo con lo observado por Welsh et al. (2004) en cepas aisladas en USA en el año 2002, niveles elevados de resistencia a eritromicina se observaron en las cepas de P. multocida y M. haemolytica estudiadas.
Estos resultados coinciden también con los reportados por Aguadé y Romero (2000) en cepas aisladas de terneras con neumonías en Tijuana, México. En nuestro trabajo se encontraron altos niveles de sensibilidad a penicilina y ampicilina, estos resultados son discordantes con los informados por Aguadé y Romero (2000) en cuyo trabajo el 100% de las cepas fueron resistentes. Los niveles de sensibilidad a tetraciclinas en las cepas de P. multocida fueron superiores a los observados por Vigo et al. (2011) en cepas procedentes de aves y cerdos y de la misma manera superiores a los reportados por Aguadé y Romero (2000) a partir de aislamientos bovinos. Por otro lado las bacterias evaluadas presentaron altos niveles de sensibilidad a la enrofloxacina, coincidiendo con los hallazgos reportados por Lamm et al. (2012). Singer et al. (1998) demostraron la importancia de determinar regionalmente los patrones de resistencia de Pasteurella spp. a diversos antibióticos luego de observar variaciones en la efectividad de ampicilina y tetraciclina en bovinos de California. En nuestro país es escasa la información existente, y si bien son múltiples los factores que podrían influenciar la respuesta clínica del tratamiento a campo, consideramos importante que los veterinarios de laboratorios y de campo promuevan el uso responsable de los antimicrobianos, ya que su utilización indiscriminada hace factible la proliferación de cepas bacterianas resistentes resultando en el fracaso del tratamiento de los animales con neumonía.
Bibliografía
Aguadé y Romero (2000) Vet México 31:153-156.
Lamm et al. (2012) J Vet Diagn Invest 24:227-282.
Singer et al. (1998) J Am Vet Med Assoc 212:1001-1005.
Welsh et al. (2004) J Vet Diagn Invest 16:426-431.