El kit está diseñado para detectar aquellas vacas afectadas con Mastitis con el objetivo de diferenciar infecciones causadas por bacterias Gram positivas de Gram negativas. De esta manera se evita el tratamiento de los animales infectados con bacterias Gram negativas ya que muchos de estos casos terminan en cura bacteriológica sin utilizar antibióticos.
Con esta herramienta se logra una disminución en los costos de tratamientos, se evita el descarte de la leche con antibióticos y se minimiza la aparición de resistencia a los antibióticos en uso.
Este producto está diseñado para ser usado en el establecimiento y obtener resultados de cultivos en 24 horas.
A. Materiales provistos en el kit Masti-9®
- Tubos estériles de5 a15 ml de capacidad.
- Hisopos estériles.
- Placas Masti-9®.
- Bolsa roja para descarte de residuos patogénicos.
B. Materiales no provistos
- Guantes para protección del operador.
- Desinfectantes para limpiar los pezones.
- Toallas de papel.
- Algodón embebido en alcohol al 70%.
- Hipoclorito de sodio al 1% (Mezclar una parte de lavandina doméstica de 55 gr. de cloro por litro más cinco partes de agua corriente o destilada).
C. Instalaciones necesarias
Sala próxima a la sala de ordeño, separada de la sala de leche y de la sala de ordeño, provista de:
- Mesada con mechero de Bunsen.
- Estufa de cultivo a 37ºC.
- Heladera con freezer para la conservación de muestras y placas
D. Instrucciones para la toma de muestra
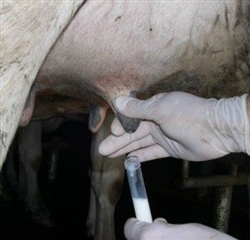
- Rotular los tubos previo al muestreo.
- Con una mano o con toalla de papel retirar toda la suciedad de la glándula y de los pezones. Si la ubre y los pezones tienen barro deben ser lavados y secados completamente antes de la toma de muestra.
- Descartar unos pocos chorros de leche del pezón y observar si la leche o la glándula presentan signos clínicos de mastitis.
- Sumergir los cuartos en un producto predipping efectivo por un tiempo de 30 segundos.
- Secar los pezones completamente con toalla de papel.
- Comenzando con los pezones que se encuentren sobre el costado más alejado de la ubre, frotar vigorosamente la punta del pezón con algodón embebido en alcohol al 70%. La punta del pezón debe ser frotada hasta que no se visualice suciedad sobre el algodón ni sobre el pezón. Se debe evitar que los pezones ya limpios tomen contacto con suciedad de la cola o patas. En rodeos donde las vacas están inquietas comenzar frotando el pezón más cercano hasta que se encuentre limpio, tomar la muestra y pasar al próximo pezón.
- Tomar las muestras de leche de los cuartos individuales comenzando por los pezones más cercanos.
- Para tomar la muestra sacar la tapa del tubo, pero cuidando de no dejarla sobre el piso ni tocar la parte interna. Sostener el tubo en un ángulo de 45º durante la toma de la muestra.
- Evitar que la boca del tubo toque la punta del pezón.
- Recolectar1 a3 chorros de leche e inmediatamente poner la tapa asegurando un buen cierre.
- Colocar las muestras inmediatamente en refrigeración.
E. Instrucciones para la determinación de Mastitis en tambo
- Para comenzar el procesamiento de las muestras, colocarse los guantes de protección.
- Limpiar la superficie de trabajo con hipoclorito de sodio al 1%.
- Retirar las placas de la heladera.
- Si tienen exceso de humedad, dejar secar las placas en la estufa con la superficie del agar hacia arriba.
- Retirar las muestras de la heladera.
- Rotular las placas con Nº de caravana, cuarto, fecha.
- Cerca del mechero, agitar las muestras, tomar un hisopo, embeberlo y esparcir de forma pareja la muestra sobre la superficie del Agar GP.
- Tomar otro hisopo y de la misma manera sembrar en el Agar GN.
- Cerrar la placa e incubar con la superficie del agar hacia arriba en estufa de cultivo a 37ºC, durante 24 horas.
F. Lectura e interpretación de los resultados
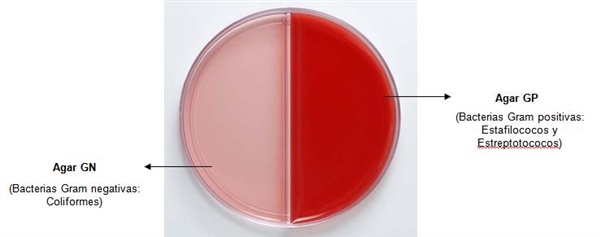
- Desarrollo en Agar GP: Gram positivas (Streptococcus spp., Staphylococcus spp. y Bacillus spp), aplicar tratamiento con antibióticos.
- Desarrollo en Agar GN: Gram negativas (bacterias coliformes), no aplicar tratamiento, realizar seguimiento del caso.
- Desarrollo de Agar GP y Agar GN: Gram positivas y Gram negativas, aplicar tratamiento con antibióticos, posible muestra contaminada.
Luego de las 24 hs. de incubación indicadas pueden desarrollar otro tipo de bacterias como así también levaduras y hongos que no deben ser tomados en cuenta en la interpretación.
G. Descarte de los materiales
Utilizando guantes, abrir cada placa y pulverizar con solución de Hipoclorito de sodio al 1%. Descartar todos los materiales dentro de la bolsa roja para residuos patogénicos para su posterior incineración.